SanofiとTeva Pharmaceutical社の抗TL1A抗体duvakitug(デュバキツグ;TEV-48574/SAR447189)が中等~重度の潰瘍性大腸炎(UC)とクローン病(CD)の患者相手のPh2b試験RELIEVE UCCDで下図の通り目標達成。
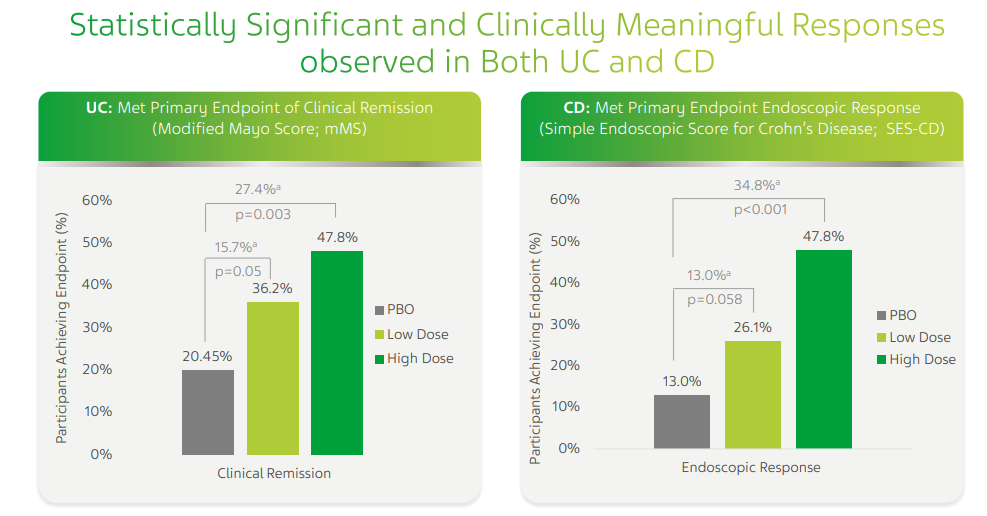
UC患者のduvakitug低用量と高用量投与のそれぞれ36%と48%が14週時点で寛解。プラセボ群のその割合は20%。
CD患者の14週時点内視鏡検査目標達成率はduvakitug低用量と高用量投与群でそれぞれ26%と48%。プラセボ群はわずか13%。
SanofiとTevaは米国FDAや欧州医薬品庁(EMA)などの目付役と相談(regulatory discussions)した後にduvakitugのPh3試験を始める。
duvakitugが阻止するTL1Aは2つの受容体の一方のDR3への結合を介して炎症や線維症に寄与。duvakitugはもう1つのTL1A受容体DcR3には手出しせずもっぱらDR3を阻害するようにできている(下図参照)。DcR3は生得のTL1A抑制因子であり、TL1A過剰を抑えていい塩梅を保つ働きを担う。

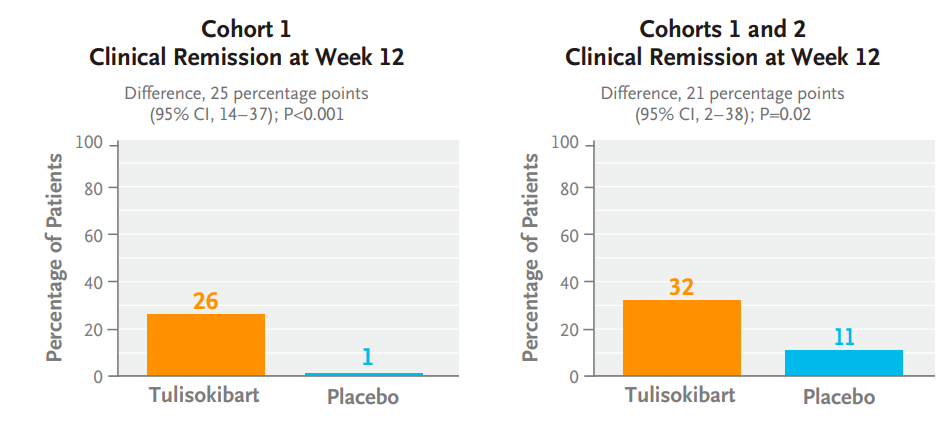
Merck & Coの抗TL1A抗体tulisokibart(ツリソキバルト)のUC患者相手のPh2試験での12週時点寛解率は3割ほど。
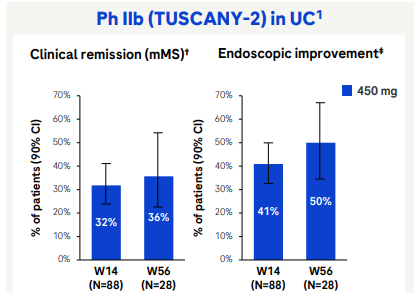
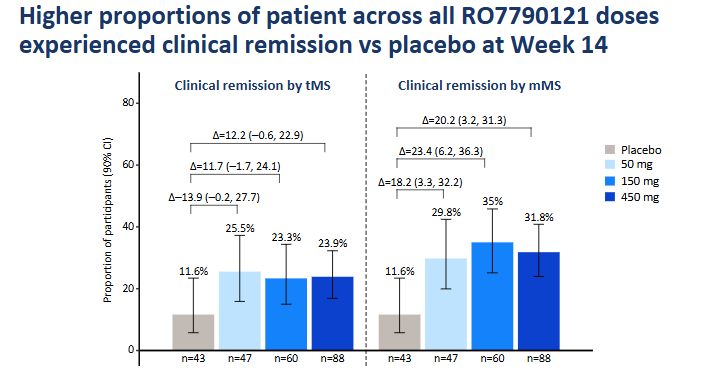
また、Rocheの抗TL1A抗体RG6631(RO7790121、PF-06480605、RVT-3101)のPh2b試験TUSCANY-2での高用量(450mg)群14週時点UC寛解率は32%ほど。どうやら用量が多いほど効果が高いというわけではなさそう。
以上より、Sanofi/TevaのduvakitugはPh2試験段階ではMerck & CoのtulisokibartやRocheのRG6631より見栄えする結果を示しているようだ。


コメント